News
新着情報
ホーム > 新着情報 > 植物病原菌のリン脂質を合成するPmt酵素の立体構造から基質特異性を解明(研究代表者:渡邊康紀准教授)
News
ホーム > 新着情報 > 植物病原菌のリン脂質を合成するPmt酵素の立体構造から基質特異性を解明(研究代表者:渡邊康紀准教授)
2025.05.21
研究ニュース
細菌の中には、植物に感染して病気を起こすものなど、周りの生き物とうまく関わるために、ホスファチジルコリン(PC)というリン脂質(細胞の膜を作る成分)をもつものがいます。このPCはPmtという酵素によって作られます。Pmt酵素は、ホスファチジルエタノールアミン(PE)という別のリン脂質の「頭」の部分に、メチル基という部品を3つ付け加えてPCを作ります。このPmt酵素にはいくつかの種類があり、PCを最後まで効率よく作れるもの(Agrobacteriumという植物病原菌のAtPmtAなど)と、途中の段階で止まってしまうもの(Bradyrhizobiumという共生細菌のBdPmtAなど)があります。なぜこのような違いが生まれるのでしょうか?
渡邊康紀准教授の研究グループは、X線結晶構造解析法と核磁気共鳴(NMR)法を駆使してAtPmtAの立体構造を初めて明らかにしました。立体構造を調べたところ、リン脂質の「頭」の部分がぴったりはまる「ポケット」があることが分かりました。Pmt酵素は、このポケットにリン脂質の頭部がはまった状態で、メチル基を付け加える反応を進めると考えられます。そして、PCを効率よく作れるAtPmtAと、途中で止まりやすいBdPmtAのポケットの形を詳しく比べたところ、ポケットを形作るアミノ酸の一つが違っていることが分かりました。このアミノ酸たった一つ違いが、ポケットの「サイズ」を変えているのです。AtPmtAのポケットは比較的広く、PCのようなメチル基が3つ付いた大きな「頭」でも収まる形をしています。一方、BdPmtAのポケットは少し狭く、PCのように大きくなった頭部は収まりにくいため、反応が途中で止まりやすくなるのです。つまり、Pmt酵素がもつ「どんなリン脂質をポケットに受け入れて、次の反応に進めるか」という性質(基質特異性)が、アミノ酸一つによって決まっていることを明らかにしました。今後、病原菌のPmt酵素のポケットにはまり込んで反応を阻害する分子を作ることで、植物を守るための新しいタイプの農薬などの開発に繋がることが期待されます。本研究は北海道大学 久米田博之 博士、愛媛大学 渡辺誠也 教授との共同研究です。本研究成果は2025年4月11日付でJournal of Biological Chemistry誌に掲載されました。論文の詳細はこちらのURLからご参照ください(https://www.jbc.org/article/S0021-9258(25)00356-4/fulltext)。
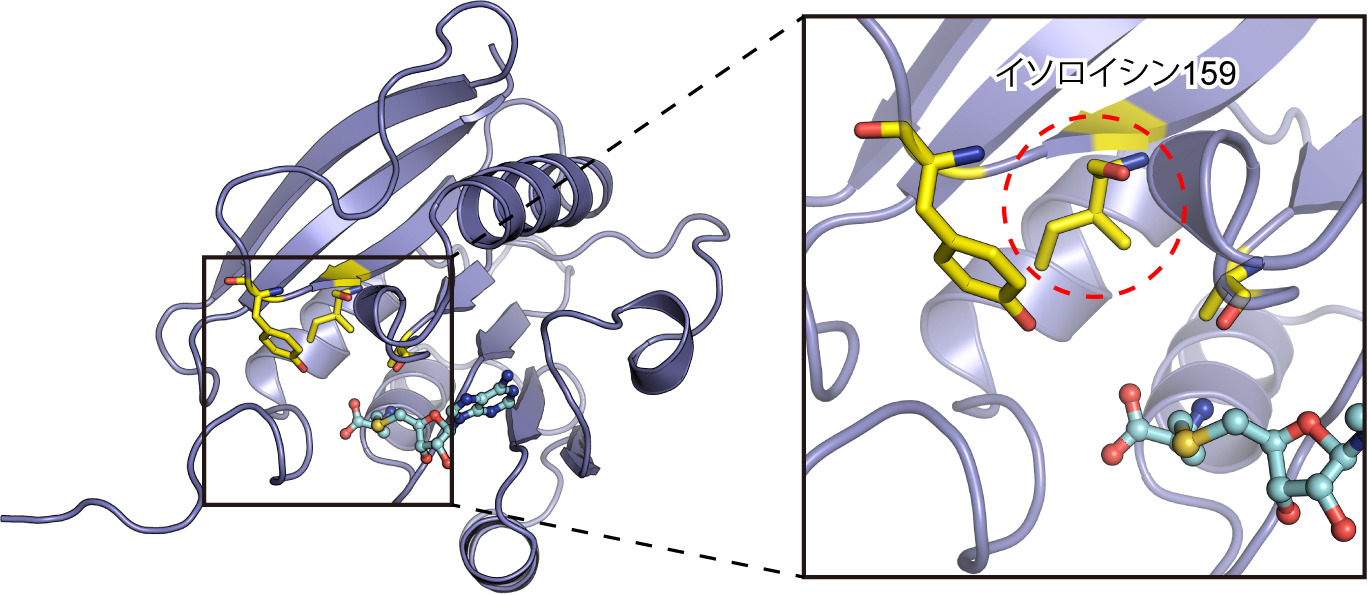
左:AtPmtAの立体構造。右:リン脂質の頭部を収容するポケットの拡大図。ポケットを形作るアミノ酸を黄色で示す。そのうち、イソロイシン159がポケットのサイズの決定に関わるアミノ酸であることを明らかにした。